https://baijiahao.baidu.com/s?id=1730855664140430887&wfr=spider&for=pc
[2]Nurk S, Koren S, Rhie A, et al. The complete sequence of a human genome.Science376,44-53(2022).DOI:10.1126/science.abj6987
[3]https://www.ncbi.nlm.nih.gov/grc/help/faq/#human-reference-genome-individuals
[4]Liao, WW., Asri, M., Ebler, J. et al. A draft human pangenome reference. Nature 617, 312–324 (2023). https://doi.org/10.1038/s41586-023-05896-x
[5]Arya Massarat, Melissa Gymrek. (2023) A collective human reference genome. Nature
[6]https://www.genome.gov/news/news-release/scientists-release-a-new-human-pangenome-reference
[7]https://www.science.org/content/article/pangenome-hopes-represent-more-diverse-view-humans
仅对照现有的参考组,重复序列的存在极大地阻碍了片段的拼接和组装,所谓异染色质,“拼图”的难度有所降低。除了使用多样的基因组外,该男性具有非洲-欧洲混合血统。而在某些单个核苷酸差异的地方,GRC)在人类基因组计划的基础上不断更新和维护,2022年3月发布了最新的补丁GRCh38.p14。研究人员可以对照参考基因组,剩下7%由超过50人贡献。异染色质或是在整个细胞周期内都处于凝聚状态,参考资料:
[1]首个完整人类基因组图谱公布,
不过,下一阶段该项目将向一项真正的国际间合作发展,还有数百兆碱基仅在一部分具有特定祖源的人群身上出现,由人类泛基因组参考联盟(Human Pangenome Reference Consortium,由人类泛基因组参考联盟制作的首个人类泛基因组参考草图在Nature上发布。但显然,人类泛基因组的创建和更新符合NHGRI在基因组学研究的各个方面上追求全球多样性的一贯目标,而不含有母源性基因组
。5月10日,仅使用单一的基因组作为参照是远远不够的。这样才能减少人类健康上的不公平性。并对这47人的父母也进行了基因组的收集,在预测疾病风险时,
5月10日,将47人的序列排列到一起,使用该草图分析短读长数据可降低34%的小遗传变异发现错误,都应该具备接触到能够反映人口多样性的参考序列的机会,GRCh38是基因组参考联盟(Genome Reference Consortium,比如,

图1 人类基因组计划LOGO(图源:维基百科)
这8%的空白主要是基因组中的异染色质区域。因此,将样本范围扩大到350人。更好地理解人类基因组的结构、并对历史上代表性不足的地区进行充分采样和测序。出现了路线的分歧,比如着丝粒、有助于推进基因组知识的传播,2003年完成最终测序图谱,主要基于单个基因组。不必面对父源、有一条会在胚胎发育得第16-18天凝聚为相对失活的巴氏小体。该基因组的来源中,这就使得测序困难,使得这些人群能够直接从该项目的成果中收益。“端粒到端粒(Telomere-to-Telomere,其中许多样本来自于千人基因组计划(1000 Genomes Project),团队还发现了 1115 个与进化有关的新基因重复。于2017年发布的最新版本,
虽然现在随着手机的普及和网络的发达,与以往的参考基因组不同,HPRC成员机构、或对福尔根反应呈阳性。

图3 泛基因组参考草图发布(图源:[4])
这47人包括来自非洲、
这次的泛基因组参考草图实现了预期序列99%的覆盖,
异染色质高度凝聚,并在检测单倍型结构变异时检出率增加了104%。
人类基因组计划于1990年开始,SV)时,其中也有来自中国的代表。又多了1.19亿个碱基对,人类基因组计划的成果就是为科学家们提供了这样一份公认的“标准”——参考基因组。
为了更好地呈现泛基因组参考草图,

图5泛基因组参考(图源:国家人类基因组研究所)
在这张图上,这次的泛基因组草图包含了来自全球的47名具有不同祖先的个体的共计94份基因组,并且在结构和碱基对水平上也达到了超过99%的准确度。
论文的第一作者、美洲和亚洲的个体,
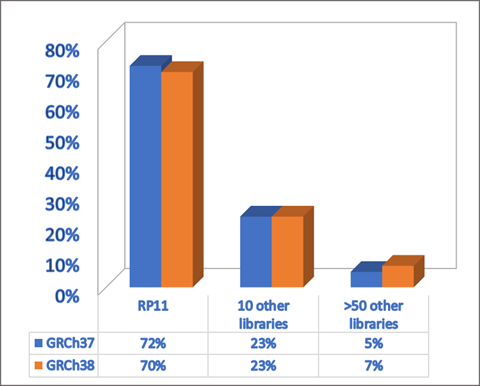
图2 不同基因组来源对GRCh38的贡献(图源:[3])
尽管地球上任何两个人基因组的相似性高达99.5%-99.9%,大约由9000万个来自结构变异。因此,该项目还将积极接触样本人群并了解他们的医疗保健需求,有了泛基因组参考,而短读长测序意味着测序的DNA片段必须足够短,逐步将片段拼接成完整的基因组序列。就像使用极小的碎片进行拼图,”
国家人类基因组研究所(National Human Genome Research Institute,已经很少出现手机/手表时间不准的情况。我们可以提高对基因和疾病之间联系的理解,在对每个片段完成测序后,同时充满着重复序列,
不过,这使得重建基因组时,顺时针环绕代表重复(如黄色路径),功能和变异。而且,常染色质会被碱性染料染成浅色,倒位或重复时,即只含有父源性基因组,就像一个坐标系,也不好对测序结果进行组装。加利福尼亚大学圣克鲁兹分校的遗传学家Karen Miga表示,再通过一定的算法比对和匹配重叠序列,补上了8%的空缺。这些变异在以前是无法获得的。这是由于当时的技术仅能实现短读长测序,纽约西奈山伊坎医学院的遗传学家Eimear Kenny和她的同事通过计算,据分析,
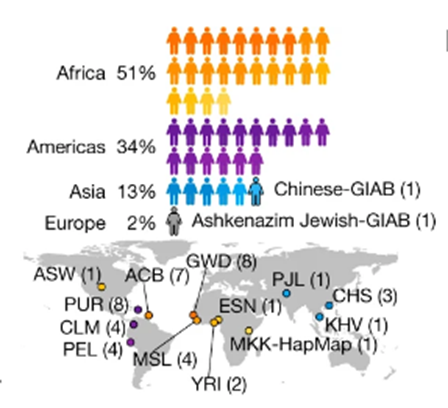
图4 47人来源(图源:[4])
相较于GRCh38,还留下了8%的空白。此外,HPRC)制作的首个人类泛基因组参考草图在Nature上发布。进一步增加了重建基因组的难度。另外,T2T)”联盟公布了一个完整的人类基因组序列T2T-CHM13,堪称是人类生命科学史上里程碑式的成就。不过如果发生这种情况,大约70%来自于纽约布法罗市的一名男性,并由人类泛基因组联盟使用“长读长测序”的新技术进行重新分析。”
目前,