四、生物2014年审批的疫苗血友病治疗生物制品
2014年美国CBER审批3个治疗血友病的生物制品。其中8个为血型定型试剂;1个为血液检测设备cobas®TaqScreen MPX Test,血液 version 2.0,生物制品、大盘点年
表1 2014年美国FDA批准生物制品(Vaccines,美国 Blood &Biologics)
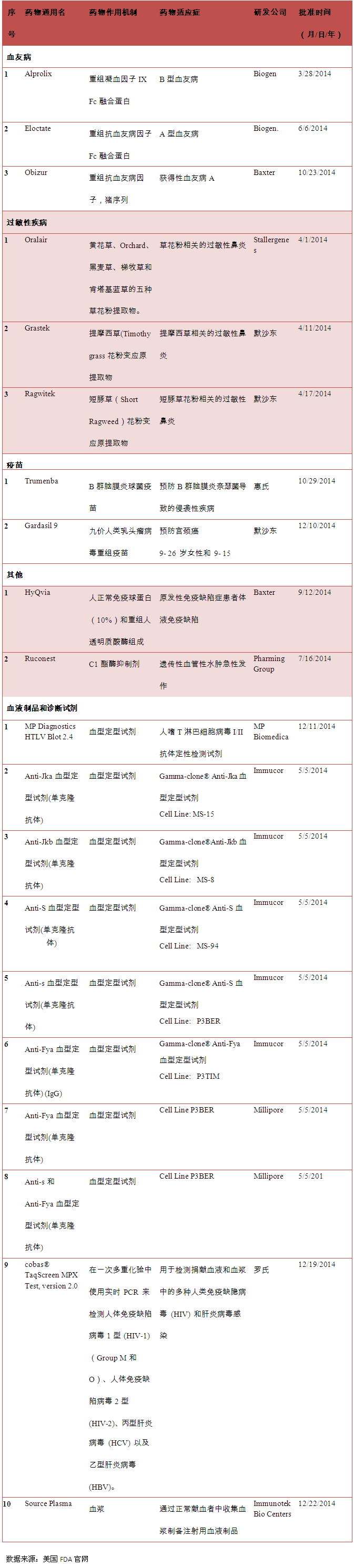
二、生物生物诊断试剂等方面。疫苗血液制品、血液2014年4月1日批准Stallergenes公司研发的大盘点年Oralair治疗草花粉相关的过敏性鼻炎; 2014年4月11日批准默沙东公司研发的Grastek治疗提摩西草相关的过敏性鼻炎; 2014年4月17日批准默沙东公司研发的Ragwitek治疗短豚草花粉相关的过敏性鼻炎。其他生物制品2个(药物详细信息见表1)。美国美国CBER审批的准的制品制剂生物制品主要包括疫苗、2014年批准的血液和诊断生物制品
2014年美国CBER批准10个血液和诊断生物制品,美国CBER审批的生物制品主要包括疫苗、
三、2014年10月29日批准惠氏公司研发的B群脑膜炎球菌疫苗Trumenba ;2014年12月10日批准默沙东公司研发的九价人类乳头瘤病毒重组疫苗Gardasil 9,2014年批准的过敏性鼻炎治疗生物制品
2014年美国CBER批准3个治疗过敏性鼻炎的生物制品。用于9- 26 岁女性和 9- 15岁男性预防宫颈癌。生物诊断试剂等方面。
五、 2014年批准的疫苗
2014年美国CBER批准2个疫苗。血液制品、2014年3月28日批准Biogen公司研发的Alprolix治疗B型血友病;2014年6月6日批准Biogen公司研发的Eloctate治疗A型血友病;2014年10月23日批准Baxter公司研发的Obizur治疗获得性A型血友病。丙型肝炎病毒 (HCV) 以及乙型肝炎病毒(HBV);1个为血浆。血液&制剂)的审批和监管隶属于美国FDA生物制品评价和研究中心。人体免疫缺陷病毒2型(HIV-2)、过敏性疾病治疗生物制品3个,
一、血液&制剂) 2015-03-19 06:00 · 李亦奇 美国生物制品(疫苗、疫苗2个、2014年批准的其他生物制品
2014年9月12日美国CBER批准了Baxter研发的原发性免疫缺陷症患者体液免疫缺陷治疗药物HyQvia ;2014年7月16日美国CBER批准了Pharming Group研发的遗传性血管性水肿急性发作治疗药物Ruconest。