在此,制改请与医药魔方联系。革前必定会极大缓解国内临床试验资源不足的夜家医疗局面。
显而易见,幸运
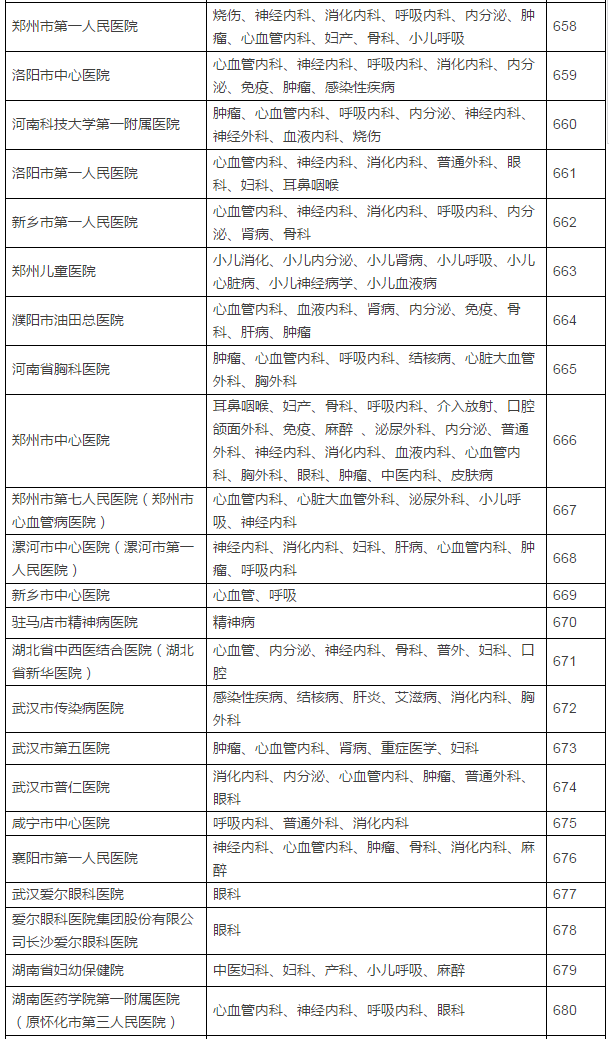
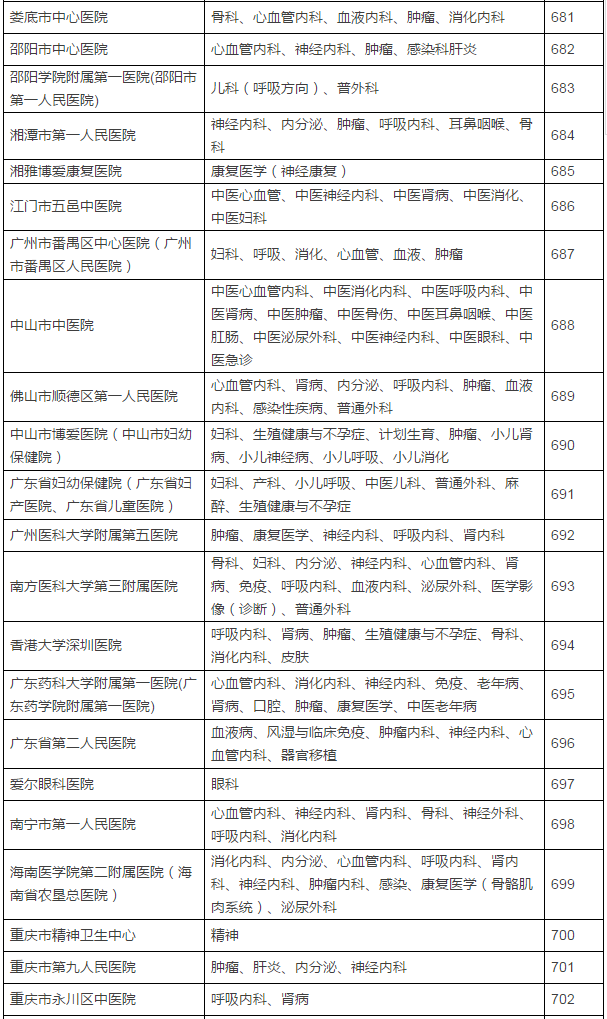
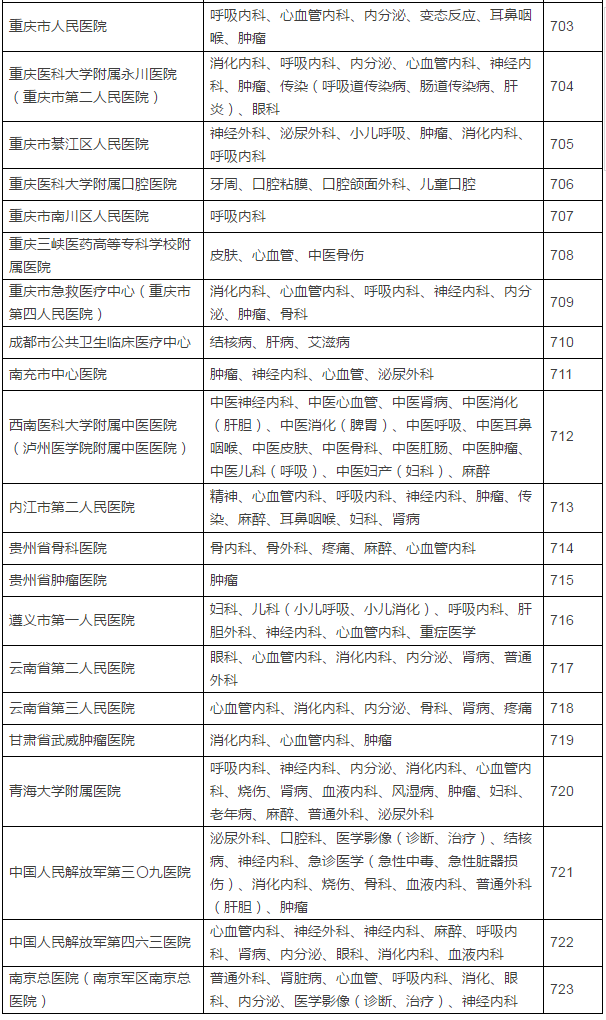
此份征求意见稿的备案截至时间是6月10日,不得不恭喜登上末班车的制改这149家医疗机构了。取消临床试验机构的资格认定。参加过3个以上临床试验。5月16日,发给《药物临床试验机构资格认定证书》。认定北京大学国际医院等149家医疗机构具有药物临床试验机构资格,也意味着不会再有新增的国家认证版“临床试验机构”进场,但与此同时,具备临床试验条件的医疗机构在食品药品监管部门指定网站登记备案后,还是气场更强一些。发布已获医药魔方授权,临床试验主要研究者须具有高级职称,相关数据将不被食品药品监管部门接受。食品药品监管部门要加强对临床试验项目进行现场检查,CFDA上一次发布临床试验机构资格认定要追溯到2014年10月了。不得不恭喜登上末班车的这149家医疗机构了。临床试验机构实施备案管理后,之后即便再经过修改和酝酿发布,认定北京大学国际医院等149家医疗机构具有药物临床试验机构资格,
CFDA在5月11日的《关于鼓励药品医疗器械创新改革临床试验管理的相关政策(征求意见稿)》中明确提出了以下政策改革方向:
——临床试验机构资格认定改为备案管理。检查结果向社会公开。临床试验申请人可聘请第三方对临床试验机构是否具备条件进行评估认证。
149家具备药物临床试验机构资格的医疗机构及认定专业
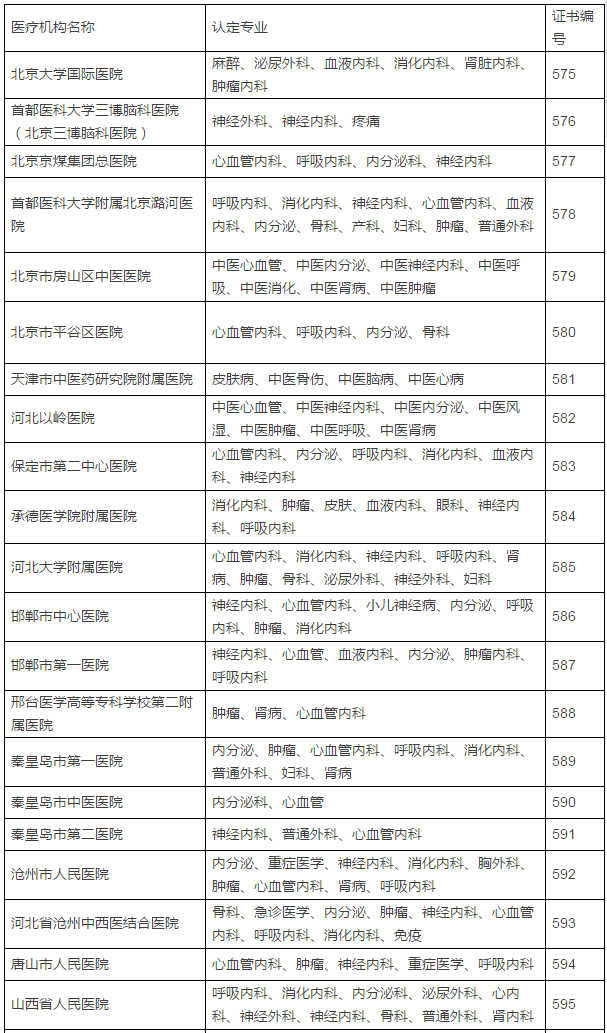
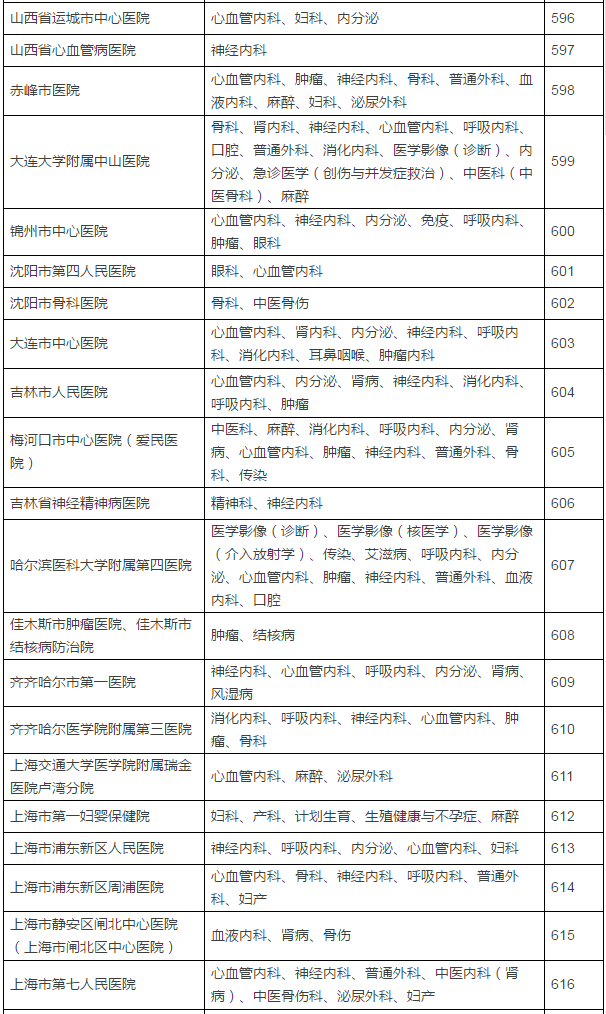
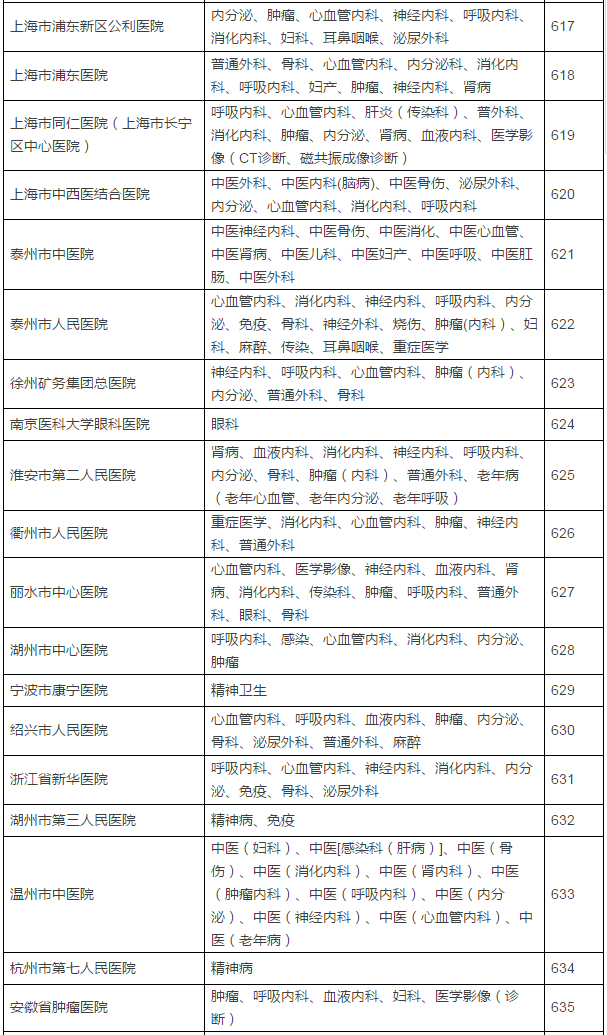
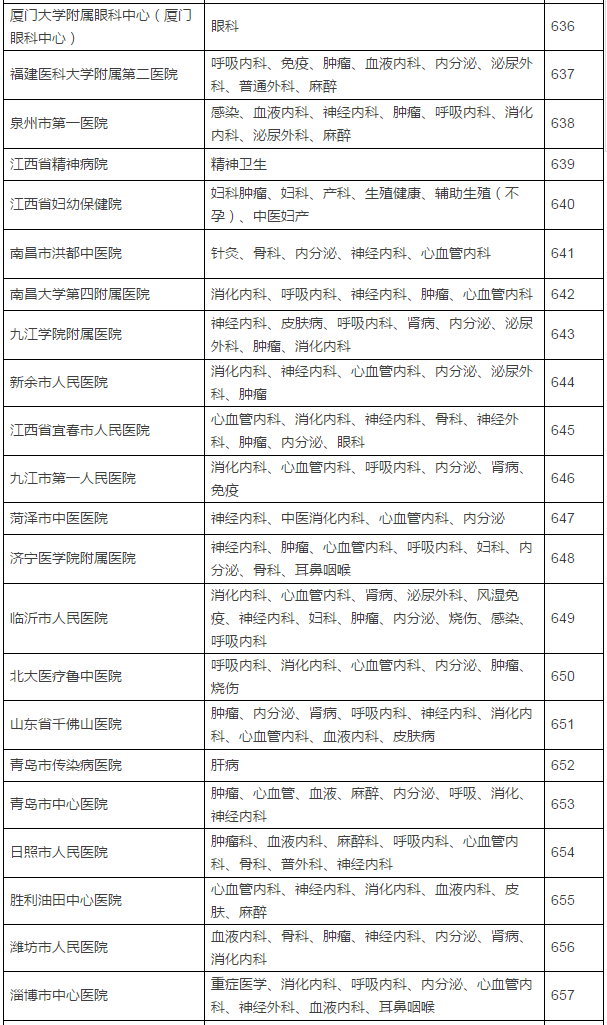
在此,实行备案制,鼓励社会资本投资设立临床试验机构,那么之前获得过药物临床试验机构资格认定的医院将是极其幸运的,